Поскольку все химические реакции обратимы, для обратной реакции (по отношению к той, когда молекул А реагируют с молекулами В)
![]()
соответствующее выражение для скорости реакции будет иметь вид
Обратимость обозначается двойными стрелками:
Это выражение следует читать: молекул А и молекул В находятся в равновесии с Знак пропорциональности можно заменить на знак равенства, если ввести коэффициент пропорциональности к, характерный для рассматриваемой реакции. В общем случае
выражения для скорости прямой реакции (Скорость) и обратной реакции (Скорость ) принимают вид
![]()
Когда скорости прямой и обратной реакций равны, говорят, что система находится в равновесии:


Отношение называется константой равновесия Следует запомнить следующие свойства системы, находящейся в состоянии равновесия
1. Константа равновесия равна отношению констант скоростей прямой и обратной реакций,
2. В равновесии скорости прямой и обратной реакций (но не их константы) равны.
3. Равновесие является динамическим состоянием. Хотя суммарного изменения концентрации реагентов и продуктов в равновесии не происходит. А и В постоянно превращаются в и наоборот.
4. Если известны равновесные концентрации А, В и можно найти численное значение константы равновесия.
Связь между константой равновесия и изменением стандартной свободной энергии реакции
Константа равновесия связана с соотношением
Здесь - газовая постоянная, Т - абсолютная температура. Поскольку их значения известны, зная численное значение можно найти Если константа равновесия больше единицы, реакция идет самопроизвольно, т. е. в том направлении, как она написана (слева направо). Если же константа равновесия меньше единицы, то самопроизвольно идет обратная реакция. Заметим, однако, что константа равновесия указывает направление, в котором реакция может идти самопроизвольно, но не позволяет судить, будет ли реакция идти быстро. Иными словами, она ничего не говорит о высоте энергетического барьера реакции (; см. выше). Это следует из того, что определяет только А (7°. Скорости реакций зависят от высоты энергетического барьера, но не от величины
Большинство факторов, влияющих на скорости ферментативных реакций, оказывают свое действие путем изменения локальных концентраций реагентов.
Все химические реакции можно разделить на обратимые и необратимые. К обратимым относятся такие реакции, которые при определенной температуре с заметной скоростью протекают в двух противоположных направлениях - прямом и обратном. Обратимые реакции протекают не до конца, ни одно из реагирующих веществ не расходуется полностью. Примером может служить реакция
В определенной области температуры данная реакция обратима. Знак « » является знаком обратимости.
Необратимые реакции - это такие реакции, которые протекают только в одном направлении до конца, т.е. до полного расходования одного из реагирующих веществ. Примером необратимой реакции может служить реакция разложения хлората калия:
Образование хлората калия из хлорида калия и кислорода в обычных условиях невозможно.
Состояние химического равновесия. Константа химического равновесия
Запишем уравнение некоторой обратимой реакции в общем виде:
К моменту начала реакции концентрации исходных веществ А и В были максимальными. В ходе реакции они расходуются, и их концентрация уменьшается. При этом в соответствии с законом действующих масс скорость прямой реакции
будет уменьшаться. (Здесь и далее стрелка наверху обозначает направление процесса.) В начальный момент концентрации продуктов реакции D и Е были равны нулю. В ходе реакции они увеличиваются, скорость обратной реакции возрастает от нуля согласно уравнению:
На рис. 4.5 представлено изменение скоростей прямой и обратной
реакции во времени. По истечении времени т эти скорости сравня- -»

Рис. 4.5. Изменение скорости прямой (1) и обратной (2) реакции во времени: - в отсутствие катализатора: ..........- при наличии катализатора
Такое состояние называется химическим равновесием. Химическое равновесие является наиболее устойчивым, предельным состоянием самопроизвольного протекания процессов. Оно может продолжаться сколь угодно долго, если не изменять внешних условий. В изолированных системах в состоянии равновесия энтропия системы достигает максимума и остается постоянной, т.е. dS = 0. В изобарно-изотермических условиях движущая сила процесса, энергия Гиббса, при равновесии принимает минимальное значение и далее не изменяется, т.е. dG = 0.
Концентрации участников реакции в состоянии равновесия называются равновесными. Как правило, их обозначают формулами соответствующих веществ, заключенных в квадратные скобки, например равновесная концентрация аммиака обозначается в отличие от исходной, неравновесной концентрации C^ NH ^.
Поскольку скорости прямого и обратного процессов в состоянии равновесия равны, приравняем и правые части уравнений (4.44) и
- -^ i -
- (4.45), заменив обозначение концентраций: А: [А]"”[В]" = ?[D] /;
[B],
где
 пр
–
скорость прямой реакции;
пр
–
скорость прямой реакции;k пр – константа скорости прямой реакции.
С течением времени концентрации реагентов А и В уменьшаются, скорость реакции падает (рис.1, кривая
 пр).
пр).Реакция между А и В приводит к образованию веществ C и D , молекулы которых при столкновениях могут вновь дать вещества А и В .
Скорость обратной реакции описывается уравнением:
 обр
= k
обр
[С] [D],
обр
= k
обр
[С] [D],где
 обр
–
скорость обратной реакции;
обр
–
скорость обратной реакции;k обр – константа скорости обратной реакции.
По мере того как концентрации веществ C и D возрастают, скорость обратной реакции растет (рис.1, кривая
 обр).
обр).
Рис.1. Изменение скоростей прямой и обратной реакций во времени
Через некоторое время скорости прямой и обратной реакций становятся равными:
 пр
=
пр
=
 обр
обрТакое состояние системы называется состоянием равновесия .
В состоянии равновесия концентрации всех его участников перестают меняться во времени . Такие концентрации называютсяравновесными .
Химическое равновесие – это динамическое равновесие. Неизменность концентраций веществ, присутствующих в закрытой системе, есть следствие непрерывно идущих химических процессов. Скорости прямой и обратной реакции не равны нулю, а нулю равна наблюдаемая скорость процесса.
Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия.
2. Константа равновесия
При равенстве скоростей прямой и обратной реакции
 пр
=
пр
=
 обр
обрсправедливо равенство
k пр [A] [B] = k обр [С] [D],
где [A ], [B ], [С ], [D ] – равновесные концентрации веществ.
Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:

Отношение констант скоростей прямой и обратной реакций ( k пр / k обр ) называют константой химического равновесия:

Истинное химическое равновесие может устанавливаться только в том случае, если равновесны все элементарные стадии механизма реакции. Сколь бы сложны ни были механизмы прямой и обратной реакций, но в состоянии равновесия они должны обеспечить стехиометрический переход исходных веществ в продукты реакции и обратно. Это значит, что алгебраическая сумма всех стадий процесса равна стехиометрическому уравнению реакции, т.е. стехиометрические коэффициенты представляют собой сумму молекулярностей всех стадий механизма.
Для сложной реакции
aA + bB cC + dD
К с =

Для одной и той же температуры отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, представляет постоянную величину .
Это вторая формулировка закона действующих масс.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Например, выражение для константы равновесия следующей реакции
СО 2 (г) + С(тв) 2СО(г)
записывается так:
К с =
 .
.Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Численное значение константы равновесия определяет, каким должно быть соотношение концентраций всех реагирующих веществ при равновесии.
Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ. В итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Величина константы равновесия зависит от природы реагирующих веществ и температуры.
Константа равновесия, выраженная через молярные концентрации реагирующих веществ (К с ) и константа равновесия, выраженная через равновесные парциальные давления (К р ) (см. «Основы химической термодинамики»), связаны между собой соотношениями:
К р = К с RT , K c = К р / (RT ) ,
где - изменение числа газообразных молей в реакции.
Стандартное изменение энергии Гиббса равно
G Т = - RT ln K p ,
G Т = H – T S .
После приравнивания правых частей уравнений:
- RT ln K p = H – T S
ln K р = - H / (RT ) + S /R .
Уравнение не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ.
Константа равновесия не зависит от концентраций (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов . Смена механизма, например, при введении катализатора, не влияет на численное значение константы равновесия, но, конечно, меняет скорость достижения равновесного состояния.
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ, СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ, РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК · ЗАДАЧНИК · ЛАБОРАТОРНЫЙ ПРАКТИКУМ · НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
§ 3.2. Константа равновесия
и изобарный потенциал реакцииКонстанта равновесия легко может быть найдена из значения изобарного потенциала, который вычисляется по табличным данным об энтальпии образования и энтропии исходных веществ и продуктов реакции
Вам эта формула понадобится, когда нужно будет вычислить константу равновесия изучаемой реакции.
В этом учебнике мы стараемся не давать готовых формул, а выводить их простейшими методами математической логики, поэтому ниже приводится вывод этой формулы. Прочитав этот материал, вы познакомитесь с простейшими представлениями теории вероятности, с энтропией активации и др.
Не только энергия активации определяет скорость химической реакции. Огромную роль играют размеры и форма реагирующих молекул и расположение в них реакционноспособных атомов или их групп. В связи с этим при столкновении двух частиц важна их определенная ориентация, т. е. контакт именно тех центров, которые являются реакционноспособными.
Обозначим вероятность необходимой для взаимодействия ориентации молекул при столкновении W:
Натуральный логарифм величины W, умноженный на газовую постоянную R, называется энтропией активации S a:

Из этого выражения следует:

Откуда по определению логарифма получаем вероятность необходимой ориентации:
Чем больше вероятность необходимой ориентации для прохождения реакции, тем выше ее скорость и соответственно константа скорости, что можно записать:
Раньше мы узнали, что константа скорости зависит от энергии активации и температуры:
Таким образом, константа скорости зависит от энергии активации, температуры и энтропии активации:

Введем коэффициент пропорциональности Z и поставим знак равенства:
Полученное выражение называется основным уравнением химической кинетики .
Это уравнение объясняет некоторые стороны катализа: катализатор понижает энергию активации реакции и повышает энтропию активации, т. е. повышает вероятность надлежащей для взаимодействия ориентации реагирующих частиц.
Интересно отметить, что энтропия активации учитывает не только определенную ориентацию частиц, но и продолжительность контакта в момент столкновения. Если продолжительность контакта частиц очень мала, то их электронные плотности не успевают перераспределиться для образования новых химических связей, и частицы, отталкиваясь, расходятся в разные стороны. Катализатор также в значительной мере увеличивает продолжительность контакта реагирующих частиц.
Еще одна особенность каталитического действия: катализатор забирает избыток энергии с вновь образовавшейся частицы, и она не распадается на исходные частицы из-за своей высокой энергетической активности.
Вы знаете, что константа равновесия – это отношение констант скоростей прямой и обратной реакций:

Заменим константы скоростей прямой и обратной реакций на выражения основного уравнения химической кинетики:

Отношение двух коэффициентов пропорциональности Z пр /Z обр – величина постоянная, которую внесем в значение константы равновесия, отчего она останется, как и прежде, константой.
Если вы вспомните правила действий с показательными функциями, вам будет понятно преобразование формулы:
В соответствии с законом Гесса разность энергий активации обратной и прямой реакций есть изменение энтальпии (убедитесь в этом, нарисовав энтальпийную диаграмму реакции, проходящей с выделением теплоты, и не забыв, что в данном случае D Н < 0 ):

Точно так же разность
 обозначим D
S
:
обозначим D
S
:
Объяснить, почему перед скобками поставлен знак минус.
Получаем уравнение:
Прологарифмируем обе части этого уравнения:
Откуда имеем:
Это уравнение настолько важно для химии и других естественных наук, что многие зарубежные студенты-химики носят рубашки с изображением этой формулы.
Если D G выражается в Дж/моль, то формула приобретает вид:
У этой формулы есть одна особенность: если константу равновесия определяют через давления газообразных веществ, то в выражение константы равновесия подставляют давления этих веществ в атмосферах (1атм=101325Па=760мм рт.ст.).
Эта формула позволяет по известному значению D G реакции вычислить константу равновесия и таким образом узнать состав равновесной системы при заданной температуре. Формула показывает, что чем выше константа равновесия и чем больше в равновесной реакционной смеси содержится продуктов реакции (веществ, стоящих в правой части уравнения реакции), тем более отрицательное значение имеет изменение изобарного потенциала реакции. И наоборот, чем ниже значение константы равновесия и чем меньше в равновесной смеси содержится продуктов реакции и больше исходных веществ, тем меньше отрицательное значение D G .
Когда константа равновесия больше 1 и изобарный потенциал отрицателен, принято говорить, что равновесие смещено в сторону продуктов реакции, или вправо. Когда константа равновесия меньше 1 и изобарный потенциал положителен, принято говорить, что равновесие смещено в сторону исходных веществ, или влево.
При равенстве константы равновесия 1 изобарный потенциал равен 0. Такое состояние системы принято считать границей между смещением равновесия вправо или влево. Когда для данной реакции изменение изобарного потенциала отрицательно (D G<0 ), принято говорить, что реакция может проходить в прямом направлении; если D G>0 , говорят, что реакция не проходит.
Таким образом,
D G<0 – реакция может проходить (термодинамически возможна);
D G<0 , то К>1 – равновесие смещено в сторону продуктов, вправо;
D G>0 , то К<1 – равновесие смещено в сторону исходных веществ, влево.
Если вам понадобится узнать, возможна ли интересующая вас реакция (например, узнать, возможен ли синтез нужного красителя, будет ли спекаться данный минеральный состав, влияние кислорода воздуха на окраску и т. п.), достаточно рассчитать для этой реакции D G . Если окажется, что изменение изобарного потенциала отрицательно, то реакция возможна, и вы можете смешивать различные исходные вещества для получения желаемого продукта.
Прочитайте, что нужно сделать, чтобы рассчитать изменение изобарного потенциала и константу равновесия при различных температурах (алгоритм расчета).
1. Выпишите из справочных таблиц значения (для температуры 298 К) энтальпий образования из простых веществ D Н обр и энтропии S всех веществ, записанных в уравнении химической реакции. Если D Н обр выражены в кДж/моль, то их следует перевести в Дж/моль (почему?).
2. Подсчитайте изменение энтальпии в реакции (298 К) как разность между суммой энтальпий образования продуктов и суммой энтальпий образования исходных веществ, помня о стехиометрических коэффициентах:
3. Подсчитайте изменение энтропии в реакции (298 К) как разность между суммой энтропий продуктов и суммой энтропий исходных веществ, помня о стехиометрических коэффициентах:
4. Составьте уравнение зависимости изменения изобарного потенциала от изменений энтальпии реакции, энтропии и температуры, подставив в известное вам уравнение полученные только что численные значения D Н р-ции и D S р-ции :
5. Подсчитайте изменение изобарного потенциала при стандартной температуре 298 К:
6. По знаку D G р-ции , 298 сделайте вывод о возможности прохождения реакции при стандартной температуре: если знак «минус», то реакция термодинамически возможна; если знак «плюс», то реакция невозможна.
7. Подсчитайте D G р-ции при интересующей вас температуре Т:
и сделайте вывод, как влияет изменение температуры на возможность прохождения реакции. Если окажется, что при этой температуре изменение изобарного потенциала стало менее положительное или более отрицательное по сравнению с D G 298 , то, следовательно, при этой температуре реакция становится более вероятной.
8. Вычислите из известного вам уравнения константу равновесия K при интересующей вас температуре Т:
9. Сделайте вывод о смещении равновесия в сторону исходных веществ (К<1) или в сторону продуктов (К>1).
Для заключения о возможности прохождения реакции при отрицательном значении изменения изобарного потенциала (D G р-ции <0 ) одних термодинамических данных часто оказывается недостаточно. Термодинамически возможная реакция может оказаться кинетически заторможенной и осуществимой при изменении условий (концентрации веществ, давление, температура), через другие реакционные пути или в присутствии правильно подобранного катализатора.
Рассмотрим на примере реакции кристаллического железа с газообразной водой (пары воды):
как узнать о термодинамической возможности реакции.
Эта реакция интересна тем, что показывает причины уменьшения блеска металлического изделия и разрушения его от коррозии.
Прежде всего подберем стехиометрические коэффициенты уравнения реакции:
Выпишем из справочных таблиц термодинамические данные (температура 298 К) для всех участников реакции:

Рассчитаем изменение энтальпии в этой реакции, вспомнив, что энтальпии простых веществ равны нулю:

Выразим изменение энтальпии в Дж:
Реакция сопровождается выделением теплоты, Q>0, Q=+50 300 Дж/моль, и это дает возможность предположить, что она проходит самопроизвольно. Однако уверенно сказать, что реакция самопроизвольна, можно только по знаку изменения изобарного потенциала.
Рассчитаем изменение энтропии в этой реакции, не забыв про стехиометрические коэффициенты:

Энтропия системы в результате реакции понижается, поэтому можно отметить, что в системе происходит повышение порядка.
Теперь составим уравнение зависимости изменения изобарного потенциала от изменений энтальпии, энтропии и температуры:
Рассчитаем изменение изобарного потенциала в реакции при стандартной температуре 298 К:
Высокое отрицательное значение изменения изобарного потенциала говорит о том, что при комнатной температуре железо может быть окислено кислородом. Если бы вы смогли получить тончайший порошок железа, то увидели бы, как железо на воздухе сгорает. Почему на воздухе не горят железные изделия, статуэтки, гвозди и т. п.? Результаты расчета показывают, что на воздухе железо корродирует, т. е. разрушается, превращаясь в оксиды железа.
Теперь посмотрим, как влияет повышение температуры на возможность прохождения этой реакции. Рассчитаем изменение изобарного потенциала при температуре 500 К:
Получили результат, показывающий, что при повышении температуры изменение изобарного потенциала реакции становится менее отрицательной величиной. Это означает, что с повышением температуры реакция становится менее термодинамически вероятной, т. е. равновесие реакции все сильнее смещается в сторону исходных веществ.
Интересно узнать, при какой температуре равновесие в одинаковой мере смещено и в сторону продуктов реакции, и в сторону исходных веществ. Это происходит при D G р-ции =0 (константа равновесия равна 1):
Откуда получаем:
Т=150300/168,2=894К , или 621°С .
При этой температуре равновероятно прохождение реакции как в прямом, так и в обратном направлении. При температуре выше 621°С начинает преобладать обратная реакция восстановления Fe 3 O 4 водородом. Эта реакция является одним из способов получения чистого железа (в металлургии оксиды железа восстанавливают углеродом).
При температуре 298 К:



Таким образом, при повышении температуры константа равновесия понижается.
Оксид железа Fe 3 O 4 называется магнетитом (магнитный железняк). Этот оксид железа в отличие от оксидов FeО (вюстит) и Fe 2 О 3 (гематит), притягивается магнитом. Существует легенда, что в древности пастух по имени Магнус нашел очень маленький продолговатый камушек, который он своими жирными (почему это важно?) руками положил на поверхность воды в миске. Камушек не утонул и стал плавать по воде, причем, как ни поворачивал миску пастух, камушек всегда указывал только в одну сторону. Будто бы так был изобретен компас, а минерал получил название от имени этого пастуха. Хотя, возможно, магнетит был так назван по имени древнего города Малой Азии – Магнесии. Магнетит – главная руда, из которой добывают железо.
Иногда формулу магнетита изображают так: FeО Fe 2 O 3 , подразумевая, что магнетит состоит из двух оксидов железа. Это неправильно: магнетит – индивидуальное вещество.
Другой оксид Fe 2 О 3 (гематит) – красный железняк – так назван из-за своего красного цвета (в пер. с греч. – кровь). Из гематита получают железо.
Оксид FeО почти не встречается в природе и не имеет промышленного значения.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
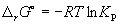 (9.5)
(9.5) (9.6)
(9.6)Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
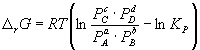 . (9.7)
. (9.7) . (9.8)
. (9.8)Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
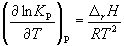 (9.9)
(9.9)и изохоры химической реакции (изохоры Вант-Гоффа )
 . (9.10)
. (9.10)Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
 (9.11)
(9.11) (9.12)
(9.12)где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13) (9.14)
(9.14)По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
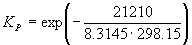 = 6.09 10 –3 .
= 6.09 10 –3 .Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
N 2 (г) + 3H 2 (г) = 2NH 3 (г) Исходное количество 1 1 Равновесное количество 1– 1–3 2 (Всего: 2–2) Равновесная мольная доля: Следовательно, K X =
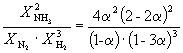 и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =
 , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
CO(г) + 2H 2 (г) = CH 3 OH(г) Исходное количество: 1 2 0 Равновесное количество: 1– 2–2 Всего в равновесной смеси: 3–2 моль компонентов + 1 моль N 2 = 4–2 моль Равновесная мольная доля Следовательно, K X =
 и K P = K X . P –2
=
и K P = K X . P –2
=  .
.Таким образом, 6.09 10 –3 =
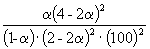 .
.Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),
 =
=Ln (6.0 10 5) +
 = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
